
开年以来,各省飞检力度不断加大,开展频率也更加密集!国家药监局的一位司长在公开场合表示,2018年飞检100家医疗器械公司数还不够,未来要加大飞检力度。明年起,飞检医械企业的数量要翻倍。
9月27日,河南省食药监局官网发布通告称,近期,河南省食品药品监督管理局依据 “双随机、一公开”原则,按照原国家食品药品监管总局办公厅《关于第一类、第二类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知》(食药监办械监[2017]120号)要求,对33家医疗器械生产企业组织并且开展了双随机飞行检查。

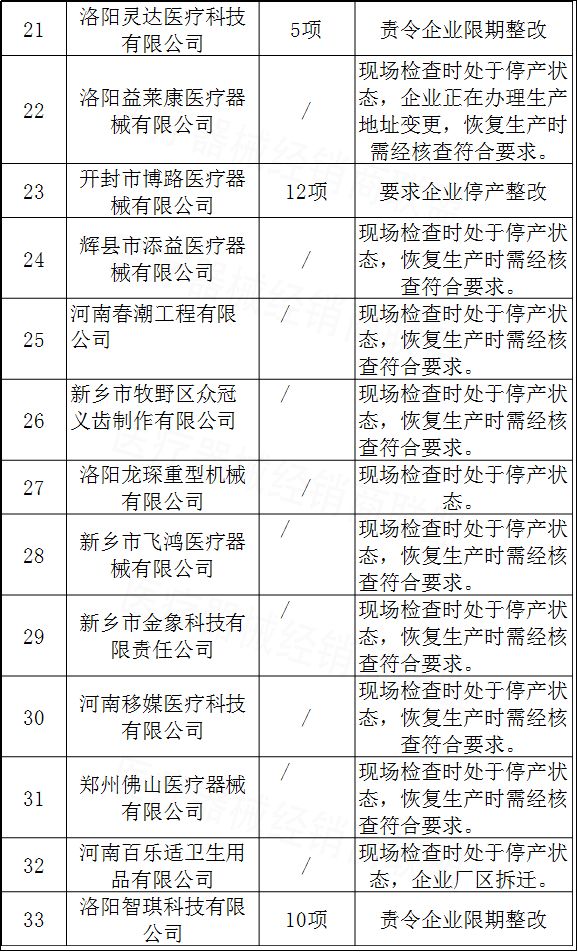
紧接着9月28日,江西省食药监局官网通报对南昌市雷意医疗器械有限公司等13家医疗器械生产企业飞行检查情况。
2018年9月13日-14日,省局组织对7家第二、三类医疗器械生产企业,6家第一类医疗器械生产企业实施了飞行检查。
(一)检查发现,南昌市雷意医疗器械有限公司脱脂棉不合格批次20151019无生产记录、检验记录,未对不合格品进行评审和采取改进措施。无2017年原材料、产品检验记录。检验室无纯化水制备装置,无白度仪、分析天平、索氏提取器、紫外灯等仪器设施。该企业质量管理体系存在严重问题,南昌市局应依法责令企业停产整改,企业整改完成拟恢复生产的,应提出书面申请,由市局开展核查符合标准要求后方可恢复生产。
(二)检查发现,萍乡神灸医疗器械有限公司成品库中灸疗机的包装标签上无生产日期,抽查编号为00317、00398的产品无生产记录。未配备专职检验人员,未与主要原材料净化滤芯盒供应商签订质量协议。该企业质量管理体系存在严重问题,萍乡市局应依法责令企业停产整改,企业整改完成拟恢复生产的,应提出书面申请,由市局开展核查符合标准要求后方可恢复生产。
(三)检查发现,中外合资江西奥格兰医疗器械有限公司、南昌振丰医疗器械有限公司、南昌市华泰医疗器械有限公司、九江高科制药技术有限公司、上海托福生物科技有限公司江西分公司等5家企业存在一般项目不符合规范要求,南昌、九江、新余市食品药品监督管理局应督促企业限期整改并开展跟踪检查。
(一)检查发现,信州区志诚石膏厂不能提供标识批号为C1821的生产、原料采购记录。未制定主要生产设备球磨机和搅拌机和主要检验设备电动抗折试验机的操作规程。产品技术方面的要求中对固化线胀系数指标要求与实际检验判定准则不一致。未与主要的组成原材料石膏供应商签订质量协议,石膏区贮存的296包石膏粉无标签标识,无质量检验机构岗位人员任命文件。该企业质量管理体系存在严重问题,上饶市局应依法责令企业停产整改,督促企业修订产品技术方面的要求并重新备案。企业整改完成拟恢复生产的,应提出书面申请,由市局开展核查符合标准要求后方可恢复生产。
(二)检查发现,江西安普康实业有限责任公司、余江县健鑫医用器材有限公司、赣州雅佛生物医材有限公司、江西领行药业有限公司、江西金思康药业有限公司等5家企业存在一般项目不符合规范要求,抚州、鹰潭、赣州、吉安、宜春市局应责令企业限期整改并开展跟踪检查。
各级食品药品监管部门要依据医疗器械生产质量管理规范和要求,督促企业认真落实整改,对涉及违反《医疗器械监督管理条例》及相关法律和法规的,应当依法严肃处理,对存在缺陷的产品,应按照《医疗器械召回管理办法》的规定召回。有关处理情况及时报告省局医疗器械监督管理处并加强日常监管。